研究揭示了两种蛋白质相互作用以促进细胞运动 转移的复杂方式
当我们体内的细胞需要移动(例如,攻击感染或治愈伤口)时,细胞蛋白质会发送和接收一系列信号,这些信号将细胞在正确的时间引导到正确的位置。这是癌细胞可以劫持以扩散到新的组织和器官的过程。
现在,由密歇根大学生命科学研究所领导的一组研究人员阐明了这一过程的关键驱动力。这项发现计划于10月16日发表在《科学进展》上,不仅对正常健康状况下的细胞迁移,而且对乳腺癌,前列腺癌和其他类型的癌症都提供了重要的见解。
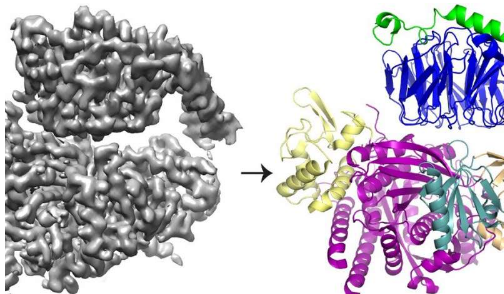
研究人员专门探测了一种叫做P-Rex1的蛋白质(磷脂酰肌醇3,4,5-三磷酸依赖性Rac交换子1),当它与另一种蛋白质Gbg结合时会被激活。尽管在15年前就发现了P-Rex1,但对这两种蛋白质如何相互作用以及这种相互作用如何导致细胞运动的了解仍然很少。
研究人员结合结构生物学和生物化学技术,揭示了与Gbg结合的P-Rex1 的结构,提供了这种复杂激活过程如何展开的快照。
LSI研究人员,该研究的主要作者詹妮弗·卡什(Jennifer Cash)说:“了解这种蛋白质复合物的结构可提供机制细节,使我们能够了解其调控方式。” “而且当我们了解它的调控方式时,我们可以开始考虑如何修改该调控并抑制癌症中的P-Rex1信号传导。”
研究小组发现,Gbg结合到P-Rex1的广泛表面上,该表面由几个不同的蛋白质结构域组成。先前的研究提供了关于哪个域(或多个域)绑定Gbg的争论。但是这项最新研究能够通过使用较新的技术从更大角度了解蛋白质来解决冲突。
普渡大学(Purdue University)生物科学教授,该研究的资深作者之一约翰·特斯默(John Tesmer)表示:“我们想从整体上看待这种酶,为此,我们确实需要进入冷冻电磁法。”
低温电子显微镜或低温电子显微镜使研究人员能够研究使用其他结构生物学技术(例如P-Rex1的复杂,交织结构)无法可视化的蛋白质。该过程涉及将蛋白质冻结在薄薄的水层中,然后使用电子捕获其形状的图像。然后,将数十万张图像平均以创建3-D结构。
LSI助理教授,该研究的高级作者迈克尔·西恩弗罗科说,除了阐明Gbg如何结合和激活P-Rex1外,这些新发现还成为冷冻EM发展的重要试金石。
用cryo-EM测定的大多数结构是较大的对称分子。相比之下,P-Rex1的结果代表了迄今为止通过cryo-EM实现的最小的不对称蛋白质的高分辨率结构。此外,P-Rex1中的一个大结构域具有以前没有在任何其他哺乳动物蛋白质中发现的结构或折叠,因此需要研究小组逐一构建它-这是一项用冷冻EM数据完成的艰巨任务。
密西根大学医学院的生物化学助理教授Cianfrocco说:“ Cryo-EM仍然是一个相对较新的领域,人们真的很想知道可以将其极限推进多远。”
《科学进展》的论文的标题为“ Cryo 电子显微镜的结构和P-Rex1-Gbg信号支架的分析”。